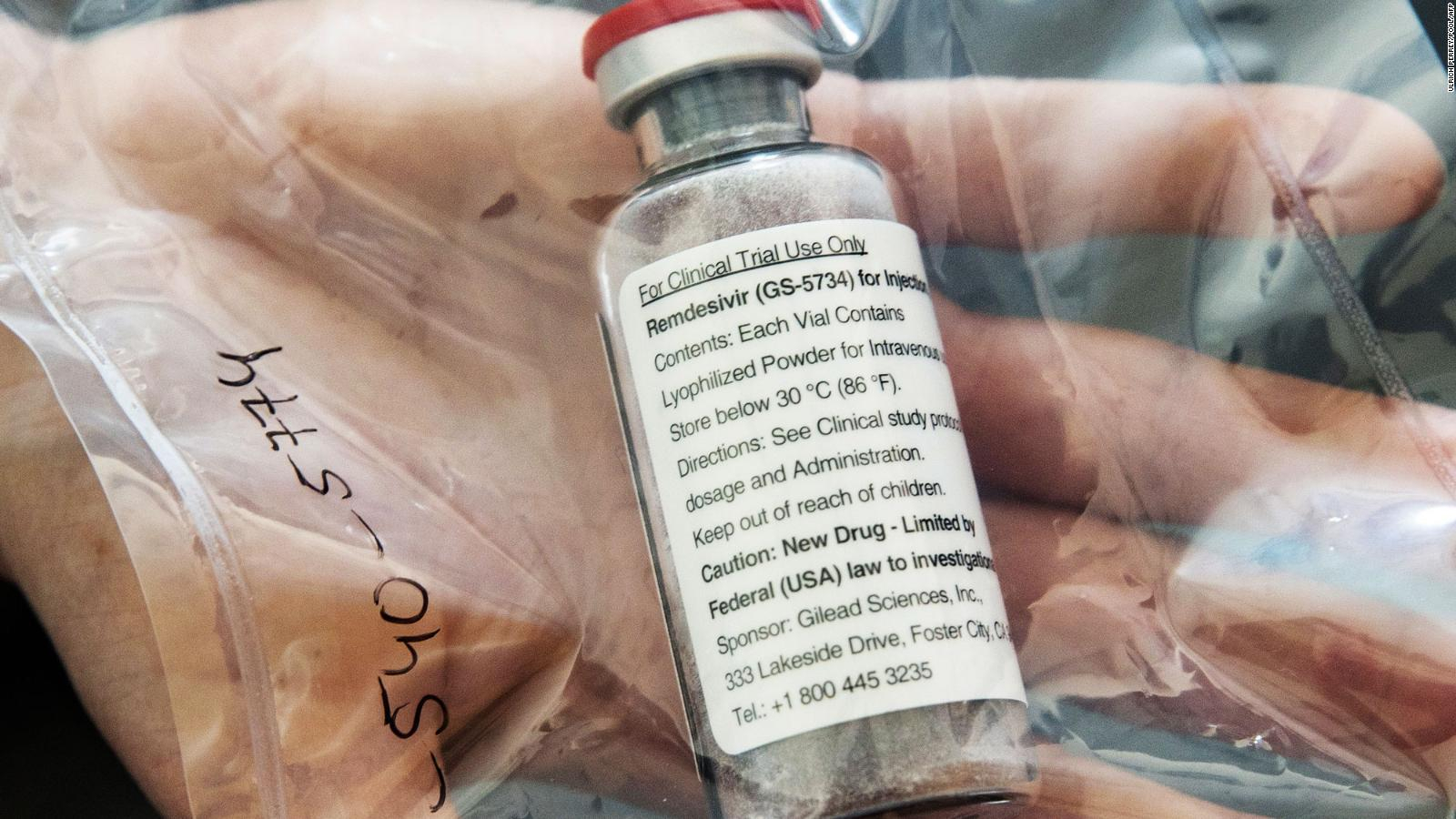
El presidente de los Estados Unidos, Donald Trump, anunció este viernes que la Administración de Medicamentos y Alimentos (FDA, por su acrónimo en inglés), otorgó una autorización de emergencia para el uso del antiviral remdesivir en pacientes con coronavirus en estado grave.
La decisión, reportada por la agencia Bloomberg, llega dos días después de que Gilead, el laboratorio que produce el antiviral, publicara un estudio preliminar sobre su eficacia en pacientes que habían contraído la enfermedad. Según indicó, los pacientes que recibieron remdesivir se recuperaron un 31% más rápido que aquellos que recibieron un placebo.
“La acción de hoy representa un paso importante en nuestros esfuerzos para colaborar con investigadores e innovadores para proveer a pacientes de acceso a nuevas terapias cuando sea apropiado y, al mismo tiempo, apoyar próximos pasos de la investigación para continuar evaluando si son seguras y efectivas”, indicó en un comunicado el titular de la FDA, stephen Hahn.
“Como parte del compromiso de la FDA de acelerar el desarrollo y la disponibilidad de posibles tratamientos para covid-19, la agencia ha tenido discusiones con Gilead Sciences con respecto a hacer que remdesivir esté disponible para los pacientes lo más rápido posible, según corresponda” dijo el portavoz de la FDA Michael Felberbaum en un comunicado.
El estudio financiado por el Gobierno encontró que los pacientes que tomaron remdesivir se recuperaron más rápido que los pacientes que no lo tomaron. No es un jonrón, pero los funcionarios federales están dispuestos a brindar cualquier esperanza que puedan en una pandemia que ha infectado a más de 1 millón de estadounidenses y ha matado a más de 60 mil.
El jefe del Instituto Nacional de Alergias y Enfermedades Infecciosas (NIAID, por sus siglas en inglés) se mostró optimista sobre los resultados.
“Los datos muestran que remdesivir tiene un efecto claro, significativo y positivo para disminuir el tiempo de recuperación”, dijo el Dr. Anthony Fauci en la Casa Blanca durante una reunión con el presidente Donald Trump.
Los resultados del ensayo preliminar muestran que remdesivir mejoró el tiempo de recuperación para pacientes con coronavirus de 15 a 11 días. Eso es similar al efecto que el medicamento contra la influenza Tamiflu tiene sobre la gripe. Tamiflu tampoco cura a los pacientes rápidamente, pero puede reducir cuánto tiempo están enfermos.
“Aunque una mejora del 31% no parece un golpe de gracia del 100%, es una prueba de concepto muy importante”, dijo Fauci sobre el remdesivir. “Lo que ha demostrado es que un medicamento puede bloquear este virus”. Remdesivir también puede reducir la probabilidad de que los pacientes mueran.
“Los resultados también sugirieron un beneficio de supervivencia, con una tasa de mortalidad de 8% para el grupo que recibió remdesivir versus 11,6% para el grupo de placebo”, dijo el NIAID.
Normalmente, los datos sobre la eficacia de un medicamento no se divulgarían tan pronto en un ensayo preliminar.
Pero “siempre que tengas pruebas claras de que un medicamento funciona, tienes la obligación ética de informar de inmediato a las personas del grupo placebo para que puedan tener acceso”, dijo Fauci.
Remdesivir se encuentra entre varios medicamentos que se prueban contra covid-19, pero el ensayo del NIAID es el primero que se realiza de acuerdo con las normas destinadas a obtener la aprobación de la FDA.
Cerca de mil 090 personas participaron en el ensayo a nivel internacional, dijo Fauci, calificándolo como “el primer ensayo aleatorio controlado con placebo de alta potencia”.
Pero la Organización Mundial de la Salud (OMS) dijo que es demasiado pronto para comentar sobre los resultados del ensayo remdesivir publicados el miércoles, y aún así, Trump ya tomó su decisión.
“Por lo general, no hay un estudio que saldrá y que cambiará las reglas del juego”, dijo la Dra. Maria Van Kerkhove, líder técnica de la OMS para la respuesta al coronavirus.
Van Kerkhove dijo que la agencia generalmente reúne evidencia de varios estudios antes de revisar y criticar la evidencia.
“A veces puede tomar varias publicaciones para determinar el impacto final de un medicamento”, dijo el Dr. Mike Ryan, director ejecutivo del programa de emergencias sanitarias de la OMS.
¿Qué es el remdesivir?
Es una droga experimental producida por la empresa Gilead Sciences. La empresa lo describe como un “análogo nucleotídico con actividad antiviral de amplio espectro”.
La palabra clave aquí es experimental, pues como aclara la empresa, el remdesivir no ha sido aprobado para ningún uso por ningún país del mundo.
“Es una medicina experimental de la que no se ha establecido que sea segura o eficaz para el tratamiento de ninguna condición”, explican.
¿Para qué ha sido probado?
El remdesivir fue probado para combatir el virus del Ébola. También ha sido usado contra el MERS y el SARS, que también son coronavirus y que producen enfermedades respiratorias similares al covid-19.
Aunque tuvo poco éxito contra el ébola, varios estudios en animales han demostrado que podría ayudar a prevenir y tratar los coronavirus. “El remdesivir ha demostrado actividad in vitro e in vivo en modelos animales contra los patógenos virales del MERS y el SARS y eso indica que el remdesivir podría tener potencial contra el covid-19”, explica Gilead Sciences.
Con información de CNN. Si quieres consultar la investigación completa puedes entrar al siguiente enlace:
https://cnnespanol.cnn.com/2020/04/30/la-fda-autorizara-el-uso-de-remdesivir-para-covid-19-despues-de-que-ensayos-mostraran-un-efecto-positivo-en-el-tiempo-de-recuperacion/